Metallfreie Kohlenstoffelektrode aus Biomasse
Die Gruppe präsentiert eine metallfreie Kohlenstoffelektrode, die aus reichlich vorhandenen Biomassenmaterialien hergestellt wird und einen hohen elektrochemischen Wirkungsgrad aufweist, während das Problem der Korrosion aufgrund der Materialwahl dadurch angegangen wird, dass sie absichtlich zugelassen wird. Die Wasserstoffproduktion auf der Kathodenseite findet ungehindert statt, unabhängig davon, welche Art von Reaktion an der Anode stattfindet – entweder die katalytische Sauerstoffentwicklungsreaktion (OER, Wasseroxidation) oder eine milde Verbrennung von Kohlenstoff (Kohlenstoffoxidation). Diese Strategie der „akzeptablen Korrosion“ ist möglich, weil die Elektroden auf Kohlenstoff basieren und aus Abfallbiomasse synthetisiert werden. Im Gegensatz zu den kommerziell verwendeten Elektroden (IrOx, RuOx) oder Materialien auf Übergangsmetallbasis, kann die Elektrode auf reiner Kohlenstoffbasis aufgrund der Nachhaltigkeit ihrer Versorgung und ihrer Skalierbarkeit als Opferelektrode verwendet werden. Abbildung 1 (unten) veranschaulicht den vorgeschlagenen Energie- und Materialzyklus.
Solarenergie wird zum Anbau von Biomasse genutzt, die anschließend zu Biokraftstoffen verarbeitet wird. Bei der Verarbeitung von Biomasse bleiben zwischen 10-50 Gewichts-Prozenten unbrauchbare organische Substanz als Nebenprodukt zurück, im Allgemeinen in Form von Huminstoffen und Holzkohle. Die ungenutzte Biomasse wird in Kohlenstoffelektroden umgewandelt und dann in Elektrolyseuren verwendet, in denen aus erneuerbaren Quellen erzeugter Strom die Wasserelektrolyse antreibt. Die Elektroden auf Kohlenstoffbasis korrodieren schließlich durch Oxidation zu CO2, das als Nebenprodukt mit einer Rate erzeugt wird, die nicht höher ist, als es beim Wachstum der Biomasse verbraucht wird. Beachten Sie, dass diese Bedingung erfüllt ist, solange nur Biomasse zur Herstellung der Kohlenstoffelektroden verwendet wird. Im Wesentlichen bietet eine OER-Elektrode einfach einen Weg, durch den elektrische Energie in chemische Bindungen überführt werden kann. Während die meisten Materialien den für diesen Prozess erforderlichen Bedingungen nicht standhalten können, stellen wir durch die Herstellung von Opferelektroden aus Materialien, die sonst verbrannt würden, Abfallmaterialien einer umsichtigeren Verwendung zu. In diesem Fall wird sowohl Energie aus Elektrizität als auch Energie aus Kohlenstoff in Form von Wasserstoff gespeichert.
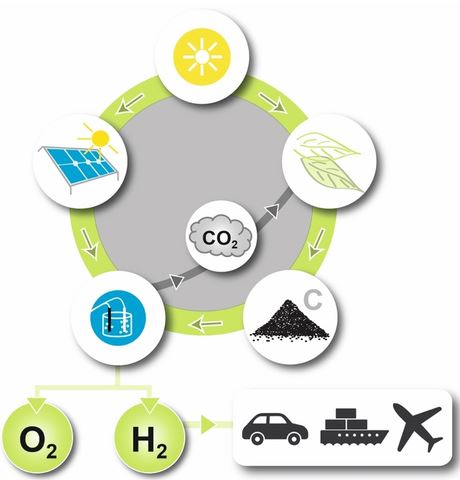
Geschlossener Kohlenstoffkreislauf, wenn Biomasse als erneuerbarer Vorläufer für Opferelektroden auf Kohlenstoffbasis verwendet wird. Die Sonne liefert Energie zur Umwandlung von CO2 in Biomasse sowie Strom für den Wasserspaltungsprozess zur Herstellung von „grünem“ Wasserstoff – Grafik © chemistry-europe.onlinelibrary.wiley.com – CC-BY 4.0
Ergebnisse und Diskussion
Obwohl sich viele frühere Arbeiten auf das Verständnis des Abbaumechanismus von Kohlenstoffmaterialien unter elektrochemischen Bedingungen konzentriert haben, scheint es, dass Korrosion ein unvermeidlicher Prozess ist, und sie wurde als der größte Nachteil der Verwendung von Kohlenstoffelektroden gegenüber Edelmetallelektroden bezeichnet. Es gibt jedoch einige interessante Eigenschaften von Kohlenstoffelektroden, die sie bei richtiger Ausnutzung attraktiver machen könnten. Zum Beispiel beträgt das Oxidationspotenzial von Kohlenstoff 0,207 VRHE (RHE: reversible Wasserstoff-Elektrode), was bedeutet, dass schwach gebundene Kohlenstoffatome innerhalb fester Kohlenstoffstrukturen bei einem potenzial oxidiert werden könnten, das niedriger ist als das theoretische potenzial von 1,23 VRHE für den OER-Prozess. Dies könnte einen energieärmeren Weg zur Herstellung von Wasserstoff bieten, was bedeutet, dass niedrigere Potenziale benötigt werden, um die Reaktion anzutreiben. Obwohl das Standard-Oxidationspotenzial von Kohlenstoffmaterialien nicht festgelegt ist und stark von der Kohlenstoffstruktur abhängt, ist es im Allgemeinen viel niedriger als beim OER-Prozess. Der Kohlenstoffoxidationsprozess ist ein Prozess mit geringerer Energie als der Sauerstoffentwicklungsprozess, was darauf hindeutet, dass die Kohlenstoffoxidation günstiger als die Wasseroxidation ist, wenn Wasser elektrolysiert wird, um Wasserstoff zu erzeugen. Nichtsdestotrotz ist der katalytische OER-Prozess der gewünschte Prozess, da er nicht zu einer Degradation der Elektrode und einer einmaligen stöchiometrischen Wasserstoffproduktion führt. Erwähnenswert ist auch, dass es Fälle von metallfreien Kohlenstoffen als hocheffiziente Anoden für die Wasserspaltung gibt. Die hohe Aktivität kommt nicht vom Kohlenstoff selbst, da er eine Selbstoxidation erfährt, bevor es zur OER kommt. Die sauerstofffunktionellen Gruppen auf der hochgraphitischen Kohlenstoffoberfläche haben die Fähigkeit, ppb-Konzentrationen von Eisenverunreinigungen aus dem Elektrolyten einzufangen. Die neu gebildeten Eisenspezies auf der Kohlenstoffoberfläche stellen die wirklichen aktiven Stellen für OER dar und schützen den Kohlenstoff vor tiefer Oxidation. Die Probleme der Kohlenstoffoxidation und der Verunreinigungen sollten auch bei diesen heteroatomdotierten Kohlenstoffmaterialien berücksichtigt werden.
Eine gemessene Oxidationskurve einer Kohlenstoffprobe ist in Abbildung 2 a dargestellt, um grundlegende elektrochemische Eigenschaften des Kohlenstoffs zu veranschaulichen. Das Kohlenstoffmaterial ist ein Vertreter eines nicht-graphitischen Pulvers (geglühter hydrothermaler Kohlenstoff) und wurde in einem Drei-Elektrodensystem in Ar-gesättigtem 0,1 M KOH auf eine glasartige Kohlenstoffelektrode tropfenbeschichtet (siehe Methoden in den Hintergrundinformationen). Die beiden Peaks der differenzierten Kurve (gestrichelte Linie) bestätigen den katalytischen Sauerstoff-Entwicklungsprozess (Einsatzpotenzial 1,52 VRHE) und den Kohlenstoffoxidationsprozess (Einsatzpotenzial 1,02 VRHE). Im Gegensatz zum OER-Prozess wird bei dieser Reaktion die Anode auf Kohlenstoffbasis verbraucht, und die stöchiometrische Produktion von Wasserstoff findet an der Kathode statt. Ein Hauptproblem bei der Verwendung von Opferkohlenstoffelektroden könnte sein, dass die Erzeugung von H2 weniger wirtschaftlich ist als die direkte Verwendung von Kohlenstoff als Festbrennstoff in Verbrennungsmotoren oder für die Biomassevergasung. Etablierte Verfahren wandeln die Biomasse nur durch stöchiometrische Konversion direkt in flüchtige Produkte wie Gase, Brennstoffe oder Kohlenstoffmaterialien um. Das Verfahren ist daher durch den einmaligen Verbrauch von Biomasse begrenzt. Wird ein Molekül Glukose, das stellvertretend für die Biomasse verwendet wird, vollständig oxidiert, beträgt die Verbrennungswärme etwa 2800 kJ/mol. Im Gegensatz dazu würde eine totale Verkokung etwa 450 kJ/mol erzeugen, während bei einer typischen hydrothermalen Behandlung von Glukose, die zur Gewinnung der Elektroden auf Kohlenstoffbasis eingesetzt wird, etwa 4,3 mol Kohlenstoff und zusätzliche flüchtige Gase entstehen. Die freigesetzte Energie liegt somit zwischen den ersten beiden Prozessen (schwarz gepunktet). Eine Anwendung des geglühten hydrothermalen Kohlenstoffs als Opferelektrode und die schlimmstmögliche Annahme, dass keine elektrokatalytische OER, sondern eine 100 przentige milde Oxidation stattfindet, würde nicht zu einer schlechteren Energiebilanz führen als die direkte direkte Verbrennung der Glukose ohne Berücksichtigung des Carnot-Wirkungsgrades. Eine Erhöhung des Verhältnisses in Richtung elektrokatalytischer Wasserstoffproduktionsprozess weg von der milden Oxidation würde zu einer viel besseren Energiebilanz führen, da die Wasserstoffproduktion pro Kohlenstoffatom mehrmals stattfinden könnte. Darüber hinaus wird die Verbrennung von Kohlenstoff durch den Carnot-Wirkungsgrad begrenzt, bei dem nur 35-40 % der Verbrennungsenergie effizient genutzt werden können. Im Gegensatz dazu stehen beim elektrochemischen Oxidationsprozess theoretisch 100 % der Energie für den elektrochemischen Wasserstofferzeugungsprozess zur Verfügung.
->Folgt: Kohlenstoffpellets als Grundmaterie