Treibhausgas N2O abbauendes Enzym entschlüsselt
Das Treibhausgas Distickstoffmonoxid (N2O) entsteht als Nebenprodukt industrieller Prozesse und durch Düngemitteleinsatz in der Landwirtschaft. Es trägt zunehmend zum Klimawandel und zum Abbau der Ozonschicht bei, verbleibt zudem lange in der Atmosphäre, weil es chmisch unreaktiv ist. In der Natur ist bislang nur ein einziges Enzym bekannt, das dieses Gas in harmlosen Stickstoff und Wasser umwandeln kann: die N2O-Reduktase. Diese ist jedoch ein kupferhaltiges Metallenzym und als solches empfindlich gegenüber dem Sauerstoff in der Atemluft. Christoph Müller und Lin Zhang aus der Arbeitsgruppe von Prof. Oliver Einsle am Institut für Biochemie der Universität Freiburg haben nun zusammen mit Prof. Juan Du und Prof. Wei Lü vom Van Andel Research Institute in Grand Rapids/USA einen wesentlichen Fortschritt im Verständnis dieses Enzyms erzielt.
Komponenten einer molekularen Maschine isoliert und charakterisiert
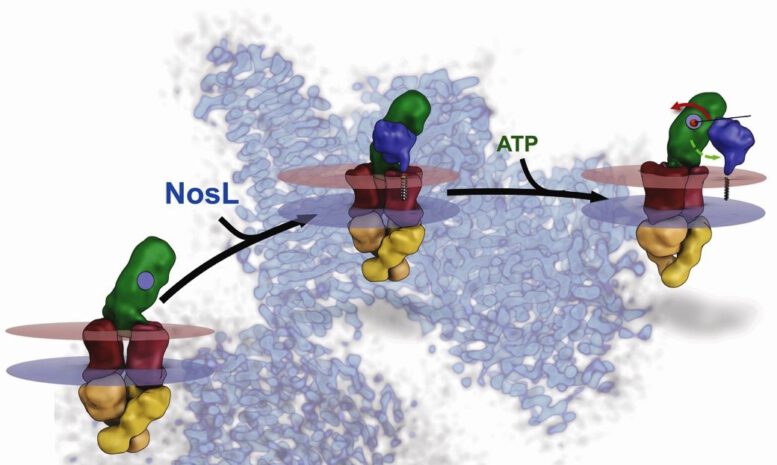
Drei Zustände des Reifungsapparats der N2O-Reduktase: Ein Komplex der Proteine NosF (gelb), NosY (rot) und NosD (grün) ändert seine Konformation unter Verbrauch biochemischer Energie und kann so ein Kupferion von dem Transportprotein NosL (blau) übernehmen und im nächsten Schritt an das Enzym weiterleiten – Grafik © AG Einsle
Im Hinblick auf biotechnologische Anwendungen der N2O-Reduktase ist es von entscheidender Bedeutung, die Bereitstellung von Kupferionen während des Zusammenbaus des Enzyms in der Zelle zu verstehen und zu kontrollieren. Die Wissenschaftler haben daher die Komponenten einer mehrteiligen molekularen Maschine, die diesen Zusammenbau bewerkstelligt, isoliert und mittels Kryo-Elektronenmikroskopie charakterisiert. Ihre Arbeiten haben sie in Nature vorgestellt.
Mechanischer Prozess: Reifung der Metallzentren der N2O-Reduktase
Die Reifung der Metallzentren der N2O-Reduktase ist ein überraschend mechanischer Prozess, in dem Konformationsänderungen des Membranproteins NosDFY durch den Verbrauch von biochemischer Energie in der Zelle ausgelöst werden. Dies versetzt den Komplex in die Lage, ein einzelnes Kupferion von einem speziellen Transportprotein, NosL, zu übernehmen und dann der noch kupferfreien oder nur teilassemblierten N2O-Reduktase anzubieten.
Neue Funktion entdeckt
Durch eine Vielzahl hoch aufgelöster Strukturmodelle konnten die Forschenden die Einzelschritte dieses komplexen Prozesses in hohem Detail abbilden und verstehen. Sie entdeckten eine bisher nicht beschriebene Funktion dieser wichtigen Klasse von Membranproteinen und machten einen großen Schritt hin zu einer Nutzbarmachung des Enzyms N2O-Reduktase zur Reduktion atmosphärischen Distickstoffmonoxids.
Faktenübersicht:
- Prof. Oliver Einsle ist Professor für Biochemie an der Fakultät für Chemie und Pharmazie der Universität Freiburg.
- Er und sein Team untersuchen Struktur und Funktion, sowie die Biogenese komplexer Enzymsysteme. Der Schwerpunkt der Arbeiten liegt dabei auf der enzymatischen Aktivierung kleiner Moleküle wie Stickstoff, Lachgas oder Kohlenmonoxid, die durch ihre chemische Stabilität nur schwer umsetzbar, gleichzeitig aber von großer ökologischer und ökonomischer Bedeutung sind.
- Er ist Mitglied in verschiedenen DFG-Projekten an der Universität Freiburg. 2020 wurde er in die Leopoldina gewählt.
->Quellen:
- kommunikation.uni-freiburg.de/eine-molekulare-maschine-bei-der-arbeit
- vai.orgstudy-reveals-insights-into-enzyme-that-combats-a-common-greenhouse-gas
- Originalpublikation: Müller, C., Zhang, L., Zipfel, S., Topitsch, A., Lutz, M., Eckert, J., Prasser, B., Chami, M., Lü, W., Du, J., Einsle, O. (2022): Molecular interplay of an assembly machinery for nitrous oxide reductase. Nature. DOI: 10.1038/s41586-022-05015-2.